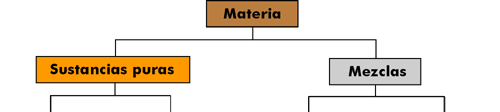
| CLASIFICACIÓN DE LA MATERIA |
|
La materia puede clasificarse en dos categorías principales:
- Sustancias puras, cada una de las cuales tiene una composición fija y un único conjunto de propiedades.
- Mezclas, compuestas de dos o más sustancias puras.
Las sustancias puras pueden ser elementos o compuestos, mientras que las mezclas pueden ser homogéneas o heterogéneas: |
|
|
|
Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su símbolo químico y se conocen 115 en la actualidad.
- Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula.Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
|
|
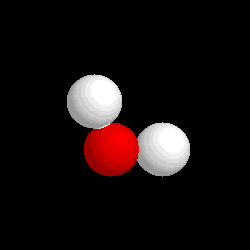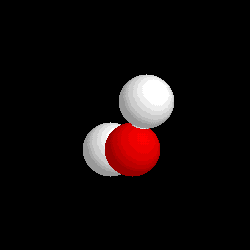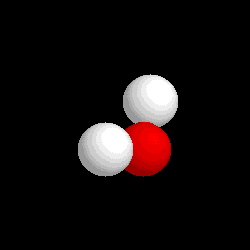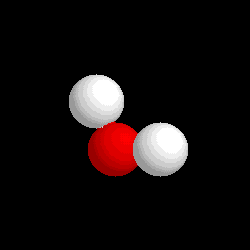
Molécula de agua (H2O), formada por 2 átomos de hidrógeno (blancos) y 1 átomo de oxígeno (rojo)
|
|
|
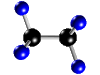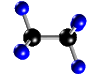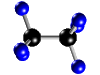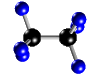
Molécula de etano (C2H6), formada por 2 átomos de carbono (negros) y 6 átomos de hidrógeno (azul)
|
|
|
Molécula de butano (C4H10), formada por 4 átomos de carbono (negros) y 10 átomos de hidrógeno (blancos)
|
Cuando una sustancia pura está formada por un solo tipo de elemento, se dice que es una sustancia simple. Esto ocurre cuando la molécula contiene varios átomos pero todos son del mismo elemento. Ejemplo: Oxígeno gaseoso (O2), ozono (O3), etc. Están constituidas sus moléculas por varios átomos del elemento oxígeno.
* Las mezclas se encuentran formadas por 2 ó más sustancias puras. Su composición es variable. Se distinguen dos grandes grupos: Mezclas homogéneas y Mezclas heterogéneas.
- Mezclas homogéneas: También llamadas Disoluciones. Son mezclas en las que no se pueden distinguir sus componentes a simple vista. Ejemplo: Disolución de sal en agua, el aire, una aleación de oro y cobre, etc.
- Mezclas heterogéneas: Son mezclas en las que se pueden distinguir a los componentes a simple vista. Ejemplo: Agua con aceite, granito, arena en agua, etc.